
Zusammensetzung
Wirkstoffe
Dexamethasoni dihydrogenophosphas ut Dexamethasoni natrii phosphas.
Hilfsstoffe
Dexamethason Galepharm Amp 4 mg/1 ml
Propylenglycolum (E 1520) 20 mg, Natrii chloridum, Dinatrii edetas, Natrii hydroxidum, Aqua ad iniectabilia q.s. ad solutionem pro 1 ml, corresp. 3.7 mg Natrium.
Dexamethason Galepharm Amp 8 mg/2 ml
Propylenglycolum (E 1520) 40 mg, Natrii chloridum, Dinatrii edetas, Natrii hydroxidum, Aqua ad iniectabilia q.s. ad solutionem pro 2 ml, corresp. 7.4 mg Natrium.
Darreichungsform und Wirkstoffmenge pro Einheit
1 Ampulle Dexamethason Galepharm Amp 4 mg/1 ml enthält 4 mg Dexamethasoni dihydrogenophosphas entsprechend 3.32 mg Dexamethason.
1 Ampulle Dexamethason Galepharm Amp 8 mg/2 ml enthält 8 mg Dexamethasoni dihydrogenophosphas entsprechend 6.64 mg Dexamethason.
Indikationen/Anwendungsmöglichkeiten
Systemische Anwendung
Hirnödem (ausgelöst durch Hirntumor, Schädel-Hirn-Trauma, intrazerebrale Blutung, neurochirurgische Eingriffe, Hirnabszess, Apoplexie, Enzephalitis, Meningitis, Strahlenschäden). Anaphylaktischer Schock (nach primärer Adrenalininjektion). Polytraumatischer Schock (Prophylaxe der Schocklunge und der Fettembolie). Status asthmaticus. Akute Schübe schwerer Dermatosen (z.B. Quinckeödem, Pemphigus vulgaris, unkontrollierbare Ekzeme, kutane Sarkoidose). Akute Blutkrankheiten (z.B. akute hämolytische Anämie). Akute primäre und sekundäre Nebennierenrindeninsuffizienz (jedoch nur bei gleichzeitiger Therapie mit einem Mineralokortikoid). Prophylaxe und Therapie von Zytostatika-induziertem Erbrechen.
Behandlung der Coronavirus-Krankheit 2019 (COVID-19) bei Erwachsenen und Jugendlichen (im Alter von mindestens 12 Jahren und mit einem Körpergewicht von mindestens 40 kg), die eine zusätzliche Sauerstoffzufuhr erfordert.
Lokale Anwendung
Periartikuläre und infiltrative Therapie, z.B. bei Periarthritis humeroscapularis, Epicondylitis, Bursitis und Tendovaginitis. Intraartikuläre Injektion, z.B. bei rheumatischer Arthritis, wenn Einzelgelenke befallen sind oder nur ungenügend auf eine Allgemeinbehandlung reagieren und bei Arthrosis deformans (entzündliche Begleitreaktion).
Dosierung/Anwendung
Die parenterale Verabreichung von Glukokortikoiden sollte Notfallsituationen und Situationen, in denen eine orale Therapie unmöglich oder unerwünscht ist, vorbehalten bleiben.
Allgemeine Dosierungsanweisungen
Dexamethason wird in einer individuellen Dosierung verabreicht, wobei Schwere und Verlauf der Krankheit, die Reaktion des Patienten sowie die voraussichtliche Behandlungsdauer berücksichtigt werden. Dabei sollte auch festgelegt werden, ob eine tägliche oder eine intermittierende Therapie angezeigt ist. Mögliche Komplikationen sind von der Dosierung sowie der Therapiedauer abhängig.
Da die volle Wirkung von Dexamethason wie bei allen Glukokortikoiden verzögert (nach 1-2 Stunden) eintritt, soll das Präparat bei lebensbedrohenden Situationen (z.B. Status asthmaticus, akutes Hirnödem) nie ohne zusätzliche sofort wirkende Therapie verabreicht werden.
Sobald die akute Phase überwunden ist, sollte eine anfangs hohe parenterale Dosierung schrittweise reduziert und durch eine orale Verabreichung ersetzt werden.
Falls innerhalb weniger Tage keine Besserung eintritt, sollte die parenterale Verabreichung von Glukokortikoiden nicht fortgesetzt werden.
Eine Langzeitbehandlung sollte nur nach sorgfältiger Beurteilung von Nutzen und Risiko durchgeführt werden. Dabei sind die Patienten sorgfältig auf Zeichen zu überwachen, die eine Verringerung der Dosierung oder ein Absetzen der Medikation erforderlich machen.
Wie jede Glukokortikoidtherapie sollte auch eine Behandlung mit Dexamethason Galepharm nicht plötzlich abgebrochen, sondern durch eine langsame, stufenweise Verringerung der Tagesdosis beendet werden, um eine Verschlechterung oder ein akutes Wiederaufbrechen der Krankheit, eine akute Nebennierenrindeninsuffizienz und ein Kortison-Entzugssyndrom zu vermeiden.
Für den Fall, dass Dexamethason Galepharm an Stelle von anderen Glukokortikoiden eingesetzt werden soll, sind die Äquivalenzdosen zu berücksichtigen (siehe «Eigenschaften/Wirkungen»).
Systemische Anwendung
Bei akuten Hirnödemformen, z.B. nach Schädel-Hirn-Verletzungen, intrazerebralen Blutungen und Schlaganfällen: initial 40-100 mg i.v.; nach 2-4 Tagen 4-8 mg i.v. oder i.m. in 2- bis 4-stündigen Abständen über 5-8 Tage.
Bei subakuten und chronischen Hirnödemformen, z.B. bei Hirntumoren, Hirnabszessen, Meningoenzephalitiden und Strahlenschäden: initial 8-12 mg i.v.; Fortsetzung der Therapie mit 4 mg i.v. oder i.m. in 6-stündigen Abständen.
Zur Initialbehandlung des anaphylaktischen Schocks (nach primärer Adrenalininjektion) sowie des Schocks durch Mehrfachverletzungen (Prophylaxe der Schocklunge bzw. der Fettembolie): 40-200 mg i.v. In schweren Fällen entweder Wiederholung der Initialdosis nach 4-12 Stunden oder Gabe von 16-40 mg 6-stündlich über 2-3 Tage i.v.
Beim Status asthmaticus: initial 40-80 mg i.v.; je nach Schwere des Falles Wiederholung der Initialdosis nach 3-6 Stunden und Weiterbehandlung mit 4 mg i.v. pro Tag und gegebenenfalls Umstellung auf orale Therapie.
Bei akuten Dermatosen und akuten Blutkrankheiten: initial 16-40 mg i.v., orale Weiterbehandlung.
Zur Therapie der akuten Nebennierenrindeninsuffizienz (Addisonkrise): Therapieeinleitung mit 8-16 mg i.v. (jedoch nur bei gleichzeitiger Therapie mit einem Mineralokortikoid).
Zur Prophylaxe und Therapie von Zytostatika-induziertem Erbrechen: am Tag vor der Therapie eine 8 mg Ampulle i.v., zu Therapiebeginn 8-12 mg i.v., danach alle 4-6 Stunden über mindestens 48 Stunden jeweils 4 mg i.v.
Zur Behandlung von COVID-19 erhalten erwachsene Patienten einmal täglich 6 mg intravenös über einen Zeitraum von bis zu 10 Tagen. Die Dauer der Behandlung richtet sich nach dem klinischen Ansprechen und den individuellen Bedürfnissen des Patienten.
Lokale Anwendung
Zur lokal-infiltrativen, periartikulären und intraartikulären Therapie unter streng aseptischen Bedingungen Injektion von 4 oder 8 mg. Bei einer Injektion in ein sehr kleines Gelenk genügen 2 mg. In Abhängigkeit von der Schwere der Erkrankung sollen nicht mehr als 3-4 Infiltrationen bzw. 3-4 Injektionen pro Gelenk erfolgen. Der Abstand zwischen den Injektionen soll 3-4 Wochen nicht unterschreiten.
Langzeitbehandlung
Eine Langzeitbehandlung über mehr als 2 Wochen kann durch Hemmung der ACTH-Freisetzung zur NNR-Insuffizienz führen, die bis zur Atrophie der Nebennierenrinde gehen kann. Der Funktionsausfall der Nebennierenrinde kann bis zu einem Jahr und länger dauern und bedeutet für den Patienten ein lebensbedrohliches Risiko in Stress- und Belastungssituationen.
Die gestörte Stressreaktion unter Glukokortikoid-Langzeittherapie macht eine Anpassung der Kortikoid-Dosis an Stressbedingungen notwendig. Hierfür wird üblicherweise Hydrocortison i.v. verwendet:
- Bei Allgemeinkrankheiten: Verdopplung, evtl. Verdreifachung der zuletzt gegebenen Dexamethason-Dosis
- Bei kleinen Eingriffen: zusätzlich vor Beginn 100 mg Hydrocortison i.v.
- Bei mittelgrossen Eingriffen: zusätzlich vor Operation 100 mg Hydrocortison i.v. und dann alle 6 Stunden je 100 mg Hydrocortison während 24 Stunden
- Bei grossen operativ-chirurgischen Eingriffen: zusätzlich vor Operationsbeginn 100 mg Hydrocortison und dann alle 6 Stunden mindestens während 72 Stunden. Weitere Behandlung je nach Verlauf
Korrekte Art der Anwendung
Dexamethason Galepharm Ampullen werden intravenös, intramuskulär, lokal-infiltrativ oder intraartikulär injiziert.
Die lokale Infiltration und die intraartikuläre Injektion müssen unter streng aseptischen Kautelen erfolgen. Die Haut wird wie zur Operation vorbereitet (gegebenenfalls Rasur, Entfettung, Alkohol, Jodanstrich). Injektionen in Sehnen sollen vermieden werden.
Spezielle Dosierungsanweisung
Kinder und Jugendliche
Die Dosierung sollte mehr auf die Schwere der Krankheit und das Ansprechen auf die Therapie als auf Alter, Körpergewicht oder Körpergrösse abgestellt werden. Bei Kleinkindern und Kindern von 0-11 Jahren sind im Allgemeinen geringere Dosen als bei Erwachsenen ausreichend. Nach einem ausreichenden Ansprechen sollte die Dosis von Dexamethason in kleinen Schritten auf die niedrigste mögliche Dosis reduziert und sobald als möglich abgesetzt werden.
i.v. Anwendung
- Hirnödem ausgelöst z.B. durch:
- Hirntumor: initial 0.5-1 mg/kg, dann 0.25-0.5 mg/kg pro Tag aufgeteilt in 4 Gaben
- neurochirurgische Eingriffe: präoperativ 1 mg/kg, dann 0.2 mg/kg alle 4 Std. für 24 Std
- Enzephalitis/Meningitis: 0.15 mg/kg alle 6 Std. für 4 Tage oder 0.4 mg/kg alle 12 Std. für 2 Tage, beginnend vor der ersten Antibiotikatherapie
- Anaphylaktischer Schock (nach primärer Adrenalininjektion): initial: Säuglinge 7.5-15 mg, ältere Kinder 4.5 mg/kg, 2. Tag: Dosisreduktion auf die Hälfte der Initialdosis, 3. Tag: Dosisreduktion auf ein Viertel der Initialdosis
- Polytraumatischer Schock (Prophylaxe der Schocklunge und der Fettembolie): initial: Säuglinge 7.5-15 mg, ältere Kinder 4.5 mg/kg, 2. Tag: Dosisreduktion auf die Hälfte der Initialdosis, 3. Tag: Dosisreduktion auf ein Viertel der Initialdosis
- Status asthmaticus: initial: Bolus von 7.5-15 mg, dann 0.15-0.3 mg/kg pro Tag
- Akute Schübe schwerer Dermatosen (z.B. Quinckeödem, Pemphigus vulgaris, unkontrollierbare Ekzeme, kutane Sarkoidose): Dosierung je nach Schweregrad: hohe Dosierung 0.3-0.45 mg/kg, mittlere Dosierung 0.15 mg/kg, Erhaltungsdosis 0.04 mg/kg, jeweils pro Tag
- Akute Blutkrankheiten (z.B. akute hämolytische Anämie): je nach Schwere der Erkrankung 6.5-40 mg/m2 Körperoberfläche für 4-5 Tage alle 28 Tage
- Akute primäre und sekundäre Nebennierenrindeninsuffizienz (falls Hydrocortison nicht verfügbar ist, jedoch nur bei gleichzeitiger Therapie mit einem Mineralokortikoid): initial Säuglinge 7.5-15 mg, ältere Kinder 4.5 mg/kg, dann Umstellung auf Hydrocortison
- Prophylaxe und Therapie von Zytostatika-induziertem Erbrechen: ca. 30 Min. vor Chemotherapie 8 mg/m2 Körperoberfläche, dann 16 mg/m2 in 2-4 Teildosen über den Tag verteilt
Behandlung von COVID-19:
Patienten mit Leberfunktionsstörungen
Dosisanpassungen sind nicht erforderlich.
Patienten mit Nierenfunktionsstörungen
Dosisanpassungen sind nicht erforderlich.
Ältere Patienten
Dosisanpassungen sind nicht erforderlich.
Kinder und Jugendliche
Für pädiatrische Patienten (Jugendliche ab 12 Jahren und älter) wird eine Dosis von 6 mg intravenös einmal täglich für einen Zeitraum von bis zu 10 Tagen empfohlen. Die Dauer der Behandlung richtet sich nach dem klinischen Ansprechen und den individuellen Bedürfnissen des Patienten. Für Patienten unter 18 Jahren stehen nur limitierte Daten zur Verfügung.
Kontraindikationen
Für die Akutanwendung bei Zuständen, in denen die Verabreichung von Glukokortikoiden lebensrettend sein kann, bestehen keine Kontraindikationen.
Bei Überempfindlichkeit gegen einen der Inhaltsstoffe darf das Arzneimittel nicht verwendet werden.
Eine intraartikuläre Injektion ist in folgenden Fällen kontraindiziert:
- Infektion des Gelenks resp. der Gelenkumgebung
- Bakterielle Arthritis
- Gelenkinstabilität
- Blutungsneigung (spontan oder auf Grund einer Antikoagulanzientherapie)
- Periartikuläre Kalzifikation
- Avaskuläre Osteonekrose
- Gerissene Sehne
- Charcot-Gelenk
Bei Infektionen im Anwendungsgebiet ist eine Infiltration ohne zusätzliche kausale Therapie kontraindiziert.
Warnhinweise und Vorsichtsmassnahmen
Die Behandlung mit Dexamethason Galepharm kann eine Immunosuppression hervorrufen und dadurch das Risiko für bakterielle, virale, fungale, parasitische und opportunistische Infektionen erhöhen. Ausserdem kann Dexamethason Galepharm die Symptomatik einer bestehenden oder sich entwickelnden Infektion verschleiern und somit die Diagnostik erschweren. Latente Infektionen, einschliesslich Tuberkulose oder Hepatitis B, können reaktiviert werden.
Wie jede Glukokortikoidtherapie sollte auch eine Behandlung mit Dexamethason Galepharm nicht plötzlich abgebrochen, sondern durch eine langsame, stufenweise Verringerung der Tagesdosis beendet werden, um eine Verschlechterung oder ein akutes Wiederaufbrechen der Krankheit, eine akute Nebennierenrindeninsuffizienz und ein Kortison-Entzugssyndrom zu vermeiden.
Bei COVID-19 Patienten, die bereits aus anderen Gründen mit systemischen (oralen) Kortikosteroiden behandelt werden (z.B. Patienten mit chronisch obstruktiver Lungenerkrankung), die aber keinen zusätzlichen Sauerstoff benötigen, sollten die systemischen Kortikosteroide nicht abgesetzt werden.
Vorsicht ist geboten bei:
- akuten viralen Infektionen (Hepatitis B, Windpocken, Herpes zoster, Herpes simplex, Keratitis herpetica, Poliomyelitis, Masern). Falls immunosupprimierte Patienten oder Patientinnen ohne vorhergehende Windpocken- oder Maserninfektion während einer Dexamethason Galepharm-Therapie Kontakt zu masern- oder windpockenerkrankten Personen haben, ist besondere Vorsicht geboten. Diese Krankheiten können in Patienten unter Dexamethason Galepharm-Therapie einen besonders schweren Verlauf nehmen. Windpockeninfektionen, die während einer systemischen Behandlung mit Kortikosteroiden auftreten, können eine schwere Verlaufsform annehmen und insbesondere bei Kindern tödlich enden. Sie erfordern eine sofortige Behandlung, z.B. mit Aciclovir i.v. Bei Risikopatienten ist eine Prophylaxe mit Aciclovir oder eine passive Immunprophylaxe mit Varizella-zoster-Immunglobulin angezeigt
- akuten und chronischen bakteriellen Infektionen: Anwendung nur unter Antibiotika-Schutz. Eine latente Amöbiase ist vor der Behandlung auszuschliessen, und Patienten mit latenter Tuberkulose oder Organtuberkulose müssen während einer Langzeitbehandlung mit Glukokortikoiden prophylaktisch Tuberkulostatika erhalten
- systemischen Mykosen und Parasitosen. Bei Patienten mit bekanntem oder vermutetem Strongyloiden-Befall können Glukokortikoide zu Rezidiven oder Ausbreitung der Krankheit führen
- ca. 8 Wochen vor bis 2 Wochen nach Schutzimpfungen mit Lebendimpfstoffen. Impfungen mit Totimpfstoffen sind grundsätzlich möglich. Es ist jedoch zu beachten, dass die Immunreaktion und damit der Impferfolg bei höheren Glukokortikoid-Dosierungen verringert sein kann
- Lymphadenitis nach BCG-Impfung
- HBsAg-positive, chronische Hepatitis
- schwer zu kontrollierendem Diabetes mellitus, da die Glukosetoleranz vermindert sein kann; es sind regelmässige Blutzuckerkontrollen durchzuführen und gegebenenfalls ist eine Anpassung der Antidiabetika-Dosis vorzunehmen
- Hypothyreose und Leberzirrhose, da in solchen Fällen die Wirkung von Glukokortikoiden verstärkt ist
- Thromboseneigung
- akutem Herzinfarkt
- schwer zu kontrollierender Hypertonie und Herzinsuffizienz
- Myasthenia gravis und gleichzeitiger Verabreichung von Cholinesterasehemmern, da in solchen Fällen die Wirkung der Cholinesterasehemmer verringert und das Risiko einer Myastheniekrise erhöht wird. (Cholinesterasehemmer sollten wenn immer möglich 24 Stunden vor der Verabreichung eines Kortikosteroids abgesetzt werden)
- Magen-Darm-Ulzera
- Osteoporose
- psychiatrischen Erkrankungen einschliesslich Suizidalität (auch anamnestisch): Es wird eine neurologische oder psychiatrische Überwachung empfohlen
- Eng- und Weitwinkelglaukom, Hornhautulzera oder -verletzungen: Es werden eine engmaschige ophthalmologische Überwachung und Therapie empfohlen
Wegen der Gefahr einer Darmperforation darf Dexamethason Galepharm nur bei zwingender Indikation und unter entsprechender Überwachung angewendet werden bei:
- schwerer Colitis ulcerosa ohne peritoneale Irritation mit drohender Perforation
- Divertikulitis
- Enteroanastomosen (unmittelbar postoperativ)
Die Symptome einer peritonealen Reizung nach gastrointestinaler Perforation können bei Patienten, die hohe Glukokortikoid-Dosen erhalten, fehlen.
Bei gleichzeitiger Anwendung von Fluoroquinolonen besteht ein erhöhtes Risiko für das Auftreten von Sehnenbeschwerden, Sehnenscheidenentzündungen und Sehnenrissen.
Während physischen Stresssituationen kann eine temporäre Erhöhung der täglichen Kortikoid-Dosis erforderlich sein.
Es können schwere anaphylaktische Reaktionen auftreten, die geeignete Vorsichtsmassnahmen (Bereitschaft zur Behandlung eines anaphylaktischen Schocks) erfordern.
Bei hohen Dosen ist auf ausreichende Kaliumzufuhr und Natriumrestriktion zu achten. Ausserdem ist der Serum-Kalium-Spiegel zu überwachen.
Bei hohen Dosen kann eine Bradykardie auftreten.
Bei lokaler Anwendung muss auf das mögliche Auftreten von systemischen unerwünschten Wirkungen und Interaktionen geachtet werden.
Die intraartikuläre Anwendung von Glukokortikoiden erhöht das Risiko für das Auftreten von Gelenkinfektionen. Eine Langzeitanwendung resp. wiederholte Anwendung von Glukokortikoiden an gewichtsbelasteten Gelenken kann zu verstärkten Abnutzungserscheinungen führen.
Nach Anwendung von Dexamethason allein oder in Kombination mit Chemotherapeutika wurde bei Patienten mit malignen hämatologischen Erkrankungen über ein Tumorlyse Syndrom (TLS) berichtet. Patienten mit Tumoren mit hoher Proliferationsrate oder hoher Empfindlichkeit gegen zytotoxische Wirkstoffe, sowie Patienten mit hoher Tumorlast haben ein grosses Risiko ein TLS zu entwickeln und sollten deshalb engmaschig überwacht werden. Zudem sollten entsprechende Vorsichtsmassnahmen getroffen werden.
Phäochromozytom-Krise
Nach der Anwendung von Kortikosteroiden wurde vom Auftreten einer Phäochromozytom-Krise berichtet, die tödlich verlaufen kann. Bei Patienten mit einem vermuteten oder diagnostizierten Phäochromozytom sollten Kortikosteroide nur nach einer angemessenen Nutzen-Risiko-Abwägung angewendet werden. Treten bei einem Patienten unter Behandlung mit Kortikosteroiden potentielle Symptome einer Phäochromozytom-Krise wie hypertensive Krise, Herzversagen, Tachykardie, Kopf-, Abdominal- und/oder Thoraxschmerzen auf, sollte an die Möglichkeit eines bisher unbekannten Phäochromozytoms gedacht werden.
Sehstörungen
Sehstörungen können unter systemischer oder lokaler Behandlung mit Kortikosteroiden auftreten. Falls Symptome wie verschwommenes Sehen oder andere Sehstörungen auftreten, sollte der Patient an einen Ophthalmologen verwiesen werden, um mögliche Ursachen wie Katarakt, Glaukom oder seltene Krankheiten wie die Chorioretinopathia centralis serosa abzuklären, die unter Behandlung mit systemischen oder lokalen Kortikosteroiden aufgetreten sind.
Frühgeborene
Nach früh einsetzender Therapie (<96 Stunden nach Geburt) bei Frühgeborenen mit chronischer Lungenerkrankung mit Startdosen von 0.25 mg/kg zweimal täglich, weisen vorliegende Daten auf negative Langzeitwirkungen hinsichtlich der neuronalen Entwicklung hin.
Hypertrophe Kardiomyopathie
Nach systemischer Verabreichung von Kortikosteroiden, einschliesslich Dexamethason, an Frühgeborene wurde über hypertrophe Kardiomyopathie berichtet. In der Mehrzahl der gemeldeten Fälle war dies nach Absetzen der Behandlung reversibel. Bei Frühgeborenen, die mit systemischem Dexamethason behandelt werden, sollte eine diagnostische Bewertung und Überwachung der Herzfunktion und -struktur durchgeführt werden (siehe «Unerwünschte Wirkungen»).
Kinder und Jugendliche
Die Anwendung von Dexamethason Galepharm während der Wachstumsphase von Kindern sollte nur nach sorgfältiger Abwägung von Nutzen und Risiko erfolgen. Es sollte entweder eine intermittierende oder alternierende Therapie durchgeführt werden.
Ältere Patienten
Da ältere Patienten ein erhöhtes Osteoporoserisiko aufweisen, sollte Dexamethason Galepharm nur unter sorgfältiger Beurteilung von Nutzen und Risiko angewendet werden.
Hilfsstoffe
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro ml, d.h. es ist nahezu «natriumfrei».
Propylenglycol
Dexamethason Galepharm Amp: 4 mg/1 ml: Dieses Arzneimittel enthält 20 mg Propylenglycol pro 1 ml, entsprechend 20 mg/ml.
Dexamethason Galepharm Amp: 8 mg/2 ml: Dieses Arzneimittel enthält 40 mg Propylenglycol pro 2 ml, entsprechend 20 mg/ml.
Die gleichzeitige Anwendung mit einem Substrat der Alkoholdehydrogenase – wie Ethanol – kann schwerwiegende Nebenwirkungen bei Neugeborenen hervorrufen.
Interaktionen
| Arzneimittel | Wirkungsveränderung |
| Saluretika, Amphotericin, Laxantien | zusätzliche Kaliumausscheidung |
| Arzneimittel, die CYP3A4 induzieren wie Rifampicin, Phenytoin, Carbamazepin, Barbiturate und Primidon | Wirkungsverminderung der Kortikoide durch Erhöhung der Clearance |
| Arzneimittel, die CYP3A4 inhibieren wie Ketoconazol, Itraconazol, Ritonavir und Cobicistat | Risiko für systemische Kortikoid-Nebenwirkungen kann erhöht sein |
| Ephedrin | Wirkungsverminderung durch beschleunigten Kortikoid-Metabolismus |
| Nichtsteroidale Antiphlogistika/Antirheumatika | Gastrointestinale Blutungs-, Ulzerations- und Perforationsgefahr erhöht |
| Salizylate | Wirkungsverminderung der Salizylate durch Erhöhung der Clearance. Bei Langzeitbehandlung erhöhtes Risiko für gastrointestinale Blutungen und Ulzerationen, die bis zur Perforation gehen können. Eine Glukokortikoid-Dosisreduktion sollte vorsichtig vorgenommen werden, da Salizylatvergiftungen auftreten können. |
| Östrogene | Wirkungsverstärkung der Kortikoide durch Verringerung der Clearance möglich |
| Impfungen mit inaktivierten Impfstoffen | Beeinträchtigung der Immunisierung möglich |
| Cholinesterasehemmstoffe | Verringerung der Cholinesterasehemmung |
| Herzglykoside | Glykosidwirkung durch Kaliummangel verstärkt |
| Orale Antidiabetika, Insulin | Blutzuckersenkung vermindert, möglicherweise erhöhter Antidiabetika-Bedarf |
| Cumarin-Derivate | Antikoagulanzienwirkung abgeschwächt oder verstärkt, eine Anpassung der Antikoagulanziendosis kann bei gleichzeitiger Anwendung notwendig sein |
| Praziquantel | Herabsetzung der Praziquantelkonzentration im Blut möglich |
| Atropin und andere Anticholinergika | Risiko, dass ein bereits gesteigerter Augeninnendruck zusätzlich erhöht wird |
| ACE-Hemmstoffe | erhöhtes Risiko für das Auftreten von Blutbildveränderungen |
| Chloroquin, Hydroxychloroquin, Mefloquin | erhöhtes Risiko für das Auftreten von Myopathien und Kardiomyopathien |
| Immunosuppressiva | erhöhte Infektanfälligkeit und mögliche Manifestation oder Verschlimmerung von latent vorhandenen Infektionen |
| Ciclosporin | Ausserdem erhöhtes Risiko für das Auftreten von zerebralen Krampfanfällen durch Erhöhung des Ciclosporin-Blutspiegels |
| Nicht-depolarisierende Muskelrelaxantien | Muskelrelaxation möglicherweise verlängert |
| Protirelin | geringere TSH-Erhöhung möglich |
| Fluoroquinolone | möglicherweise erhöhtes Risiko für das Auftreten von Sehnenbeschwerden |
Schwangerschaft, Stillzeit
Schwangerschaft
Tierstudien haben unerwünschte Wirkungen auf den Fötus gezeigt, es existieren keine kontrollierten Humanstudien. Wie alle Glukokortikoide passiert auch Dexamethason die Plazentarschranke. Bei Langzeittherapie während der Schwangerschaft sind deshalb z.B. intrauterine Wachstumsstörungen nicht auszuschliessen. Bei einer Behandlung zum Ende der Schwangerschaft besteht für den Fötus die Gefahr einer Atrophie der Nebennierenrinde, die eine ausschleichende Substitutionstherapie beim Neugeborenen erforderlich machen kann.
Deshalb sollte Dexamethason Galepharm, wie alle Glukokortikoide, während der Schwangerschaft – und besonders in den ersten drei Monaten – nicht angewendet werden, es sei denn, es ist klar notwendig. Dabei sollte bei bestehender Indikation Prednisolon (oder Prednison) allen anderen – und insbesondere den fluorierten – Glukokortikoiden vorgezogen werden, da seine Plazentagängigkeit am geringsten ist.
Bei einer vermuteten oder eingetretenen Schwangerschaft sollte unbedingt der Arzt verständigt werden.
Kinder, deren Mütter während der Schwangerschaft mit höheren Glukokortikoid-Dosen behandelt wurden, sollten sorgfältig auf Zeichen von Hypokortizismus überwacht werden.
Studien haben gezeigt, dass nach einer kurzzeitigen, vorgeburtlichen Verabreichung von Kortikosteroiden (einschliesslich Dexamethason) an Schwangere mit einem Risiko für eine späte Frühgeburt ein erhöhtes Risiko für eine neonatale Hypoglykämie besteht.
Stillzeit
Dexamethason tritt wie alle anderen Glukokortikoide in sehr geringen Mengen in die Muttermilch über und könnte u.a. die NNR-Funktion und das Wachstum des Säuglings beeinträchtigen. Mütter, die während der Stillzeit Glukokortikoide erhalten, sollten deshalb abstillen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Besonders zu Beginn der Behandlung mit Dexamethason Galepharm kann es zu Veränderungen der Fahrtüchtigkeit und der Fähigkeit, Maschinen zu bedienen, kommen. Diese Beeinträchtigung ist besonders auf Veränderungen der Stimmungslage, des Antriebes und der Konzentrationsfähigkeit zurückzuführen.
Unerwünschte Wirkungen
Die unerwünschten Wirkungen von Dexamethason sind von Dosis und Behandlungsdauer sowie von Alter, Geschlecht und Grundkrankheit des Patienten abhängig.
Die Gefahr unerwünschter Wirkungen ist bei einer kurzfristigen Kortikoidtherapie gering. Man achte jedoch auf intestinale Blutungen (oft stressbedingt), die durch die Kortikoidanwendung symptomarm verlaufen können.
Bei längerdauernder hochdosierter Therapie können die bekannten Nebenwirkungen der Glukokortikoide auftreten.
Infektionen und parasitäre Erkrankungen
Erhöhung des Infektionsrisikos, Maskierung von Infektionen, Auftreten, Verschlimmerung oder Reaktivierung von bakteriellen, viralen, fungalen, parasitischen und opportunistischen Infektionen, Aktivierung einer Strongyloidiasis.
Erkrankungen des Blutes und des Lymphsystems
Mässige Leukozytose, Lymphopenie, Eosinopenie, Polycythämie.
Erkrankungen des Immunsystems
Überempfindlichkeitsreaktionen, schwerwiegende anaphylaktische Reaktionen wie Arrhythmie, Bronchospasmus, Blutdruckerhöhung oder -senkung, Kreislaufversagen, Herzstillstand.
Bei lokaler Anwendung sind mögliche systemische unerwünschte Wirkungen und Interaktionen zu beachten.
Endokrine Erkrankungen
Nebennierenrindeninsuffizienz.
Auslösung einer Phäochromozytom-Krise bei Patienten mit vorbestehendem (auch latentem) Phäochromozytom.
Cushing-Syndrom (z.B. Vollmondgesicht, Stammfettsucht) siehe «Warnhinweise und Vorsichtsmassnahmen».
Stoffwechsel- und Ernährungsstörungen
Natriumretention mit Ödembildung, vermehrte Kalium-, Kalzium- und Phosphatausscheidung.
Gewichtszunahme, verminderte Glukosetoleranz, Diabetes mellitus, Hypercholesterinämie, Hypertriglyzeridämie, Appetitzunahme.
Psychiatrische Erkrankungen
Psychose, Manie, Depression, Halluzinationen, Affektlabilität, Gereiztheit, Antriebssteigerung, Euphorie, innere Unruhe, Schlafstörungen, Suizidalität.
Erkrankungen des Nervensystems
Erhöhter intrakranieller Druck mit Stauungspapille (Pseudotumor cerebri), Auftreten oder Verschlimmerung von Epilepsie (Krämpfe).
Augenerkrankungen
Steigerung des Augeninnendrucks (Glaukom), Linsentrübung (Katarakt), insbesondere mit hinterer subcapsulärer Trübung, Verschlimmerung der Symptome bei Hornhautulzera, Begünstigung viraler, fungaler und bakterieller Augeninfektionen, Verschlimmerung bakterieller Corneainfektionen, Ptosis, Mydriasis, Chemosis, iatrogene sklerale Perforation, selten reversibler Exophthalmus. Ausserdem bei subkonjunktivaler Anwendung Keratitis (durch Herpes simplex Viren verursacht) sowie Corneaperforationen bei Keratitis, Chorioretinopathie, verschwommenes Sehen.
Herzerkrankungen
Hypertrophe Kardiomyopathie bei Frühgeborenen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Gefässerkrankungen
Hypertonie.
Erhöhung des Arteriosklerose- und Thromboserisikos, Vaskulitis, Zunahme der Kapillarfragilität.
Erkrankungen des Gastrointestinaltrakts
Peptische Magen- und Zwölffingerdarmgeschwüre, Magenblutungen, Bauchspeicheldrüsenentzündung, Magenbeschwerden.
Erkrankungen der Haut und des Unterhautgewebes
Hautstreifen (Striae rubrae), periorale Dermatitis, Hautatrophie, punktförmige Hautblutungen (Petechien), Blutergüsse (Ekchymosen), Steroidakne, verzögerte Wundheilung, Teleangiektasien, Hypertrichosen, Veränderungen der Hautpigmentierung.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Muskelatrophie, Muskelschwäche, Myopathie, Sehnenbeschwerden, Sehnenscheidenentzündung, Sehnenrisse, Osteoporose, aseptische Knochennekrosen, Wachstumsverzögerung bei Kindern, epidurale Lipomatose.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Störungen der Sexualhormonsekretion (Ausbleiben der Menstruationsblutung, abnormer Haarwuchs, Impotenz).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Verzögerte Wundheilung. Die wiederholte intramuskuläre, intraartikuläre und subläsionale Verabreichung von Dexamethason (oder einem anderen Glukokortikoid) kann zu schweren lokalen Gewebeschädigungen (bis zu Atrophien und Nekrosen) führen.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Da die akute Toxizität von Glukokortikoiden gering ist, wurden durch akute Überdosierung von Glukokortikoiden hervorgerufene Intoxikationen bisher nur selten beobachtet. Bei chronischer Überdosierung ist mit verstärkten unerwünschten Wirkungen zu rechnen, die insbesondere das Endokrinium, den Stoffwechsel und Elektrolythaushalt beeinflussen. Für den Fall einer Überdosierung gibt es kein spezifisches Antidot, und die Behandlung ist symptomatisch.
Eigenschaften/Wirkungen
ATC-Code
H02AB02
Wirkungsmechanismus
Der Wirkungsmechanismus von Glukokortikoiden ist mehrschichtig.
Dexamethason bindet an intrazelluläre Rezeptoren und aktiviert diese. Der aktivierte Glukokortikoid-Rezeptorkomplex wandert in den Zellkern, wo er jeweils an spezifischen DNS-Bindungsstellen die Synthese bestimmter Proteine initiiert oder blockiert.
- Zu den Proteinen, deren Synthese initiiert wird, gehören unter anderem das Lipocortin 1, das die für eine Entzündungsreaktion wichtige Phospholipase A2 inhibiert, und das Angiotensin Converting Enzyme (ACE), das in den Blutdruck-Regelkreis eingreift
- Zu den Proteinen, deren Synthese inhibiert wird, gehören verschiedene Zytokine (z.B. TNF-alpha, Interleukin-2, Interleukin-6), die Zellen des Immunsystems aktivieren, und verschiedene proinflammatorische Enzyme (z.B. Kollagenase). Ebenfalls verhindert werden die Induktion der NO-Synthetase wie auch der Cyclooxigenase
Neben diesen genomischen Mechanismen, die mit einer Latenz von einer halben bis zu mehreren Stunden einsetzen, gibt es einige schnelle Effekte, die teilweise bereits bei niedriger Plasmakonzentration einsetzen (z.B. Suppression der endogenen Kortisolsekretion), und andere, die erst bei höheren Konzentrationen wirksam werden (z.B. Membranstabilisierung). Der wahrscheinlichste Mechanismus für letztere ist die Inkorporierung der Glukokortikoide in die Zellmembran als initiales Ereignis.
Pharmakodynamik
Dexamethason wirkt stark entzündungshemmend, antiallergisch (antiödematös) und immunsuppressiv, kohlenhydratstoffwechselsteigernd, unspezifisch antitoxisch (Membranschutz) und mikrozirkulationsfördernd (Stabilisierung der Hirndurchblutung).
Dexamethason hat eine sehr geringe Mineralokortikoid-Wirkung.
Die relative entzündungshemmende Äquivalenzdosis von Dexamethason im Vergleich zu anderen Glukokortikoiden beträgt 1 mg Dexamethason = 6 mg Triamcinolon bzw. Methylprednisolon = 7.5 mg Prednison bzw. Prednisolon = 30 mg Hydrocortison = 35 mg Cortison.
Klinische Wirksamkeit
Dexamethason wird wie andere Glukokortikosteroide für ein breites Indikationsspektrum angewendet. Aufgrund seiner langen biologischen Halbwertszeit eignet sich Dexamethason besonders für solche Indikationen, bei denen eine kontinuierliche Glukokortikoid-Wirkung erwünscht ist. Bei einigen Indikationen wird Dexamethason aufgrund der geringen Mineralokortikoid-Wirkung bevorzugt.
Zur Behandlung von COVID-19
Die RECOVERY-Studie (Randomised Evaluation of COVid-19 thERapY) ist eine forschungs-initiierte, individuell randomisierte, kontrollierte, offene, adaptive Plattform-Studie zur Bewertung der Wirkung möglicher Behandlungen von Patienten, die wegen COVID-19 im Krankenhaus behandelt werden.
Die Studie wurde in 176 Krankenhäusern im Vereinigten Königreich durchgeführt.
6425 Patienten erhielten randomisiert entweder Dexamethason (2104 Patienten) oder die übliche Standardtherapie (4321 Patienten). Bei 89% der Patienten war eine SARS-CoV-2-Infektion im Labor bestätigt worden.
Bei Randomisierung erhielten 16% der Patienten bereits eine invasive mechanische Beatmung oder extrakorporale Membranoxygenierung, 60% erhielten nur Sauerstoff (mit oder ohne nicht-invasive Beatmung) und 24% erhielten keine respiratorische Unterstützung.
Die Patienten waren im Mittel 66.1+/-15.7 Jahre alt. 36% der Patienten waren weiblich. 24% der Patienten wiesen in der Anamnese Diabetes auf, 27% hatten Herz-Kreislauferkrankungen und 21% eine chronische Lungenerkrankung.
Primärer Endpunkt
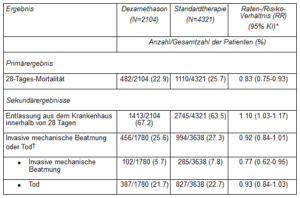
Die 28-Tage-Mortalitätsrate war mit 482 Todesfällen bei 2104 Patienten (22.9%) in der Dexamethason-Gruppe signifikant niedriger als in der Standardtherapiegruppe mit 1110 von 4321 Patienten (25.7%) (Ratenverhältnis [rate ratio, RR]: 0.83; 95%-Konfidenzintervall [KI]: 0.75-0.93; p < 0.001).
In der Dexamethason-Gruppe war die Sterblichkeit bei den Patienten, die eine invasive mechanische Beatmung erhielten (29.3% vs. 41.4%; RR: 0.64; 95%-KI: 0.51-0.81) sowie bei den Patienten, die nur zusätzlichen Sauerstoff ohne invasive mechanische Beatmung erhielten (23.3% vs. 26.2%; RR: 0.82; 95%-KI: 0.72-0.94), niedriger als in der Standardtherapiegruppe.
Es gab keinen eindeutigen Effekt von Dexamethason bei Patienten, die bei der Randomisierung keine respiratorische Unterstützung erhielten (17.8% vs. 14.0%; RR: 1.19; 95%-KI: 0.91-1.55).
Sekundäre Endpunkte
Die Patienten in der Dexamethason-Gruppe hatten einen kürzeren Aufenthalt im Krankenhaus als die in der Standardtherapiegruppe (median, 12 Tage vs. 13 Tage) und eine grössere Wahrscheinlichkeit, innerhalb von 28 Tagen aus dem Krankenhaus entlassen zu werden (RR: 1.10; 95%-KI: 1.03-1.17).
In Übereinstimmung mit dem primären Endpunkt zeigte sich der grösste Effekt hinsichtlich der Krankenhausentlassung innerhalb von 28 Tagen bei Patienten, die eine invasive mechanische Beatmung nach Randomisierung erhielten (RR: 1.48; 95%-KI: 1.16-1.90), gefolgt von der Gruppe, die nur Sauerstoff erhielt (RR: 1.15;95%-KI: 1.06-1.24). Es zeigte sich kein positiver Effekt bei Patienten, die keinen Sauerstoff erhielten (RR: 0.96; 95%-KI: 0.85-1.08).
* RR wurden altersadjustiert im Hinblick auf die Ergebnisse der 28-Tages-Mortalität und der Krankenhausentlassung. RR wurden altersadjustiert im Hinblick auf das Ergebnis des Erhalts einer invasiven mechanischen Beatmung oder des Todes und ihrer Unterkomponenten.
† Patienten, die bei Randomisierung bereits eine invasive mechanische Beatmung erhielten, wurden aus dieser Kategorie ausgeschlossen.
Sicherheit
Es gab vier schwerwiegende unerwünschte Ereignisse (SAEs) im Zusammenhang mit der Studienbehandlung: zwei SAEs einer Hyperglykämie, ein SAE einer steroidinduzierten Psychose und ein SAE einer oberen Magen-Darm-Blutung. Alle Ereignisse klangen ab.
Subgruppenanalysen
Auswirkungen der Zuordnung zur Dexamethason-Gruppe auf die 28-Tage-Mortalität, nach Alter und der randomisiert erhaltenen Atemunterstützung
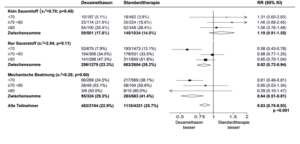
Auswirkungen der Zuordnung zur Dexamethason-Gruppe auf die 28-Tage-Mortalität, nach der randomisiert erhaltenen Atemunterstützung und Vorgeschichte einer chronischen Erkrankung

Pharmakokinetik
Absorption
Nach intravenöser Injektion von Dexamethason-21-dihydrogenphosphat erfolgt die Hydrolyse des Esters sehr schnell. Beim Menschen erscheinen 10 Minuten nach der Injektion des Esters maximale Blutspiegel des freien Dexamethasonalkohols. Intramuskulär injiziertes Dexamethason-21-dihydrogenphosphat wird bei normaler Durchblutung schnell und praktisch vollständig resorbiert, wobei 60 Minuten nach der i.m.-Applikation maximale Blutspiegel erreicht werden. Die maximale pharmakologische Wirkung tritt jedoch verzögert ein (etwa 2 Stunden nach der Injektion) und hält länger an als es der Plasmahalbwertszeit entspricht.
Distribution
4 Stunden nach der intravenösen Applikation von Dexamethason-21-dihydrogenphosphat sind maximale Dexamethason-Liquorspiegel vorhanden, die etwa ein Sechstel der gleichzeitigen Plasmakonzentration betragen. Der Abfall des Dexamethasonspiegels im Liquor erfolgt ausschliesslich langsam, so dass 24 Stunden post inject. noch etwa zwei Drittel der maximalen Konzentration zu finden sind.
Dexamethason wird dosisabhängig bis zu etwa 80 % an Plasmaproteine, vorwiegend an Plasma-Albumin, gebunden. Im Bereich sehr hoher Dosen zirkuliert der grösste Anteil frei, d.h. nicht an Eiweiss gebunden, im Blut.
Das Verteilungsvolumen von Dexamethason beträgt 0.6-0.8 l/kg.
Bei Hypalbuminämien steigt der Anteil des ungebundenen (wirksamen) Kortikoids.
Dexamethason passiert sowohl die Blut-Hirn- als auch die Plazentaschranke, und es tritt in die Muttermilch über.
Metabolismus
Dexamethason wird hauptsächlich unverändert durch die Nieren ausgeschieden. Nur zu einem kleinen Teil erfolgt beim Menschen eine Hydrierung bzw. Hydroxylierung der Moleküle, wobei als Hauptmetaboliten 6-Hydroxydexamethason und 20-Dihydrodexamethason entstehen. 30-40 % der Dexamethasonmoleküle werden in der menschlichen Leber an Glukuronsäure oder Schwefelsäure gebunden und erscheinen in dieser Form im Urin.
Elimination
Die Plasmaeliminationshalbwertszeit von Dexamethason liegt bei 3-5 Stunden, wobei die biologische Halbwertszeit mit 36-72 Stunden erheblich länger ist. Die Plasma Clearance beträgt bei Erwachsenen 2-5 ml/min/kg. Dexamethason ist nach lokalinfiltrativer und intraartikulärer Injektion von 4 mg bzw. 8 mg Dosen bei normaler Durchblutung des Applikationsortes nach durchschnittlich 4-10 Tagen vollständig eliminiert.
Kinetik spezieller Patientengruppen
Während der Schwangerschaft ist die Eliminationshalbwerts zeit verlängert.
Leberfunktionsstörungen
Schwere Lebererkrankungen (z.B. Hepatitis, Leberzirrhose) sowie Hypothyreose verlängern die Eliminationshalbwertszeit.
Nierenfunktionsstörungen
Nierenfunktionsstörungen beeinflussen die Elimination nicht wesentlich.
Kinder und Jugendliche
Bei Neugeborenen ist die Plasma Clearance geringer als bei Kindern und Erwachsenen.
Präklinische Daten
Glukokortikoide haben eine sehr geringe akute Toxizität.
Langzeittoxizität (bzw. Toxizität bei wiederholter Verabreichung)
Zur chronischen Toxizität bei Mensch und Tier liegen keine Erkenntnisse vor.
Mutagenität
Dexamethason ist unzureichend auf mutagene Wirkungen untersucht. Es liegen vorläufige Hinweise auf ein mutagenes Potential vor, deren Relevanz bisher nicht abgeklärt ist.
Kanzerogenität
Langzeituntersuchungen am Tier liegen nicht vor.
Reproduktionstoxizität
Dexamethason ruft im Tierexperiment bei Mäusen, Ratten, Hamstern, Kaninchen und Hunden Gaumenspalten und in geringem Umfang andere Fehlbildungen hervor.
Sonstige Hinweise
Inkompatibilitäten
Dexamethason Galepharm Amp sollte nicht mit anderen Arzneimitteln gemischt werden. Zur Kompatibilität mit Infusionslösungen siehe «Hinweise für die Handhabung».
Beeinflussung diagnostischer Methoden
Allergietests
Hautreaktionen können unterdrückt werden.
Blutserum-Werte
Erniedrigt: BSG, Gerinnungszeit (Lee White), Harnsäure, Testosteron, Kalium, TSH, Thyroxin, T3.
Erhöht: Glukose, Cholesterin, Natrium, Chlorid.
Urinwerte
Erniedrigt: 17-Ketosteroide.
Erhöht: Creatinin, Calcium, Glukose (bei Prädisposition).
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 25 °C lagern. Nicht im Kühlschrank lagern. Nicht einfrieren. In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Kompatibilität mit Infusionslösungen
Dexamethason Galepharm Amp sollte möglichst direkt intravenös appliziert oder in den Infusionsschlauch injiziert werden.
Dexamethason Galepharm Amp ist mit folgenden Infusionslösungen kompatibel und innerhalb von 24 Stunden zum Verbrauch bestimmt: Isotonische Kochsalzlösung und Glukoselösung 5 %.
Bei Kombination mit Infusionslösungen sind die Informationen der jeweiligen Anbieter über ihre Infusionslösungen, so auch zur Kompatibilität, zu Kontraindikationen, unerwünschten Wirkungen und Interaktionen, zu beachten.
Zulassungsnummer
66710 (Swissmedic).
Packungen
Dexamethason Galepharm Amp 4 mg/1 ml, Injektionslösung: 3 oder 10 Ampullen zu 1 ml. (B)
Dexamethason Galepharm Amp 8 mg/2 ml, Injektionslösung: 3 oder 10 Ampullen zu 2 ml. (B)
Zulassungsinhaberin
Galepharm AG, Zürich
Stand der Information
Juni 2022.